Startseite Aktuelles Fachartikel: Diagnostik und Therapie des Morbus Basedow
Mit einer jährlichen Inzidenz von etwa 40 Erkrankungen pro 100.000 Einwohner gehört der M. Basedow zu den häufigsten Autoimmunerkrankungen (1). Das Krankheitsbild wurde in Deutschland erstmals im Jahre 1840 vom Merseburger Arzt Carl von Basedow als eine Kombination von Hyperthyreose, Exophthalmus und Struma (Merseburger Trias) beschrieben und trägt im deutschsprachigen Raum seinen Namen (2). Im englischsprachigen Raum wird die Erkrankung nach dem dortigen Erstbeschreiber Robert Graves als Graves` disease bezeichnet.
Es handelt sich um eine Autoimmunerkrankung, letztlich ungeklärter Ursache. Frauen sind etwa fünfmal häufiger betroffen als Männer. Neben psychosozialem Stress gilt Nikotinkonsum als wesentlicher externer Risikofaktor. Zusätzlich werden auch eine genetische Disposition und eine familiäre Häufung vermutet.
An der Schilddrüse führt der M. Basedow durch die Aktivierung des TSH-Rezeptor-Autoantikörpers (TRAK) zur Immunhyperthyreose. Da auch außerhalb der Schilddrüse Epitope TSH-Rezeptoren exprimieren, gibt es zusätzlich extrathyreoidale Manifestationen. Während die Beteiligung des Bindegewebes (prätibiales Myxödem, Akropathie) selten ist und nur in etwa 1 % der Fälle auftritt, ist die Beteiligung der Augenhöhle im Rahmen der endokrinen Orbitopathie häufig. Durch die Beteiligung der TSH-Rezeptoren in der Augenhöhle kommt es beim M. Basedow zu einer andauernden Entzündung und nachfolgend zu Fibrosierungen. Der gesamte Inhalt der Augenhöhle, also das Weichteilgewebe um das Auge, die Augenmuskeln, die Lider und in schweren Fällen auch der Sehnerv können betroffen sein. Bei entsprechender Suche können bei fast allen Basedow-Patienten zumindest dezente morphologische Veränderungen einer endokrinen Orbitopathie festgestellt werden, klinische Symptome treten bei etwa jedem 2. Basedow-Patienten auf und mit schweren Verläufen ist bei etwa 15–20 % zu rechnen (1).

Die klinische Symptomatik ist einerseits durch die Folgen der Hyperthyreose und andererseits durch die extrathyroidealen Organmanifestationen geprägt. Anamnese und klinische Untersuchung können bereits wichtige Hinweise geben. Nicht selten ergibt sich der V. a. einen M. Basedow schon beim ersten Blick in die Augen des Patienten.
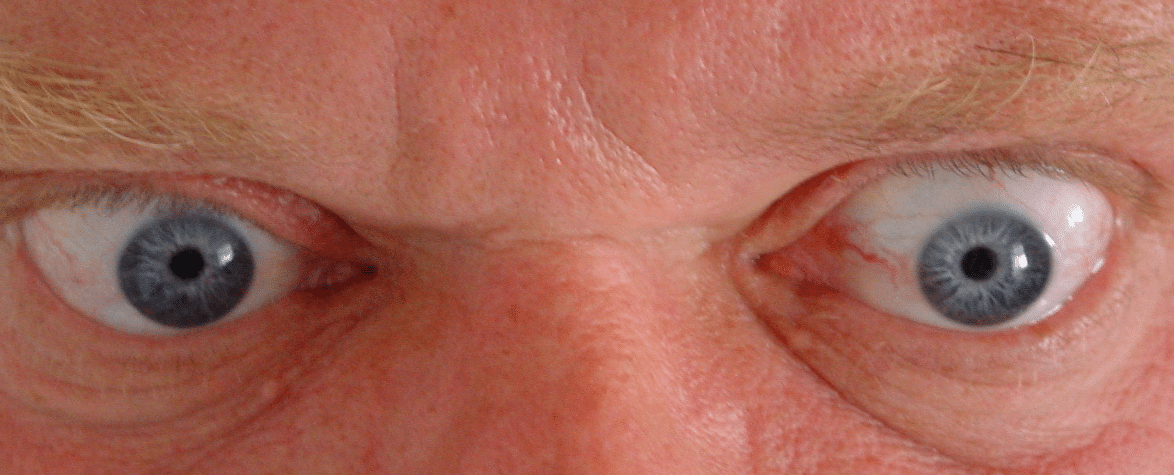
Neben dem typischen Exophthalmus, können auch eine Reihe weiterer Augensymptome festgestellt werden:
Zur Schweregradeinteilung der endokrinen Orbitopathie gibt es verschiedene Klassifikationen wie das NOSPECS-Schema, dessen verschiedene Modifikationen, die LEMO-Klassifikation oder den Clinical Activity Score (3).
| Klasse | Deutsche Bezeichnung | Englisches Original |
|---|---|---|
| 0 | Keine Zeichen oder Symptome | No signs or systems |
| 1 | Zeichen (Z.B. Lidretraktion), keine Symptome | Only signs, no symptoms |
| 2 | Weichteilbeteiligung | Soft tissue involvement |
| 3 | Exophthalmus | Proptosis |
| 4 | Muskelveränderung | Extraocular muscle involvement |
| 5 | Hornhautkomplikationen | Corneal involvement |
| 6 | Visus- u. Gesichtsfeldeinschränkungen | Sight loss |
Die Ausprägung der Symptome der Hyperthyreose korreliert nicht immer mit dem Ausmaß der Hyperthyreose im Blut. Zudem gibt es individuelle und altersabhängige Unterschiede. Bei jüngeren Patienten sind die Symptome häufig ausgeprägter als bei älteren Patienten, die nicht selten oligosymptomatisch sind und z. B. nur durch Herzrhythmusstörungen auffallen. Symptome der Hyperthyreose:
Zum Nachweis einer Hyperthyreose werden das TSH (Thyroideastimulierendes Hormon) und die freien Hormone fT3 und fT4 im Blut bestimmt. Wenn eine endokrine Orbitopathie besteht, ist eine weiterführende Diagnostik prinzipiell nicht erforderlich. Typisch für den M. Basedow ist eine Erhöhung der TRAK-Werte (TSH-Rezeptor-Antikörper) im Serum. Bei erhöhten TRAK-Werten besteht in modernen Assays eine Sensitivität und Spezifität für das Vorliegen eines M. Basedow von über 90 % (4). Hohe TPOAK (Thyroxinperoxidase-Antikörper) sind eher typisch für eine Hashimoto-Thyreoiditis, kommen aber auch in ca. 70–80 % beim M. Basedow und sogar bei Gesunden vor (1). Bei etwa der Hälfte der Basedow-Patienten findet auch eine Erhöhung der Thyreoglobulin-Antikörper.
Im Sonogramm besteht meist eine Vergrößerung der Schilddrüse mit einer diffusen Echoarmut und Zeichen der Hypervaskulariserung in der Duplex-Sonografie. Im Schilddrüsenszintigramm findet sich eine homogene und meist massiv erhöhte Tracerspeicherung in der Schilddrüse. Für die Diagnose eines M. Basedow ist eine Szintigrafie bei eindeutiger Befundlage allerdings entbehrlich (4,5). Je nach Befundkombinationen können sich im Einzelfall sinnvolle Indikationen für weitere Untersuchungen ergeben (z. B. Feinnadelpunktionen bei sonografisch suspekten Knoten, MRT Augenhöhle bei V. a. eine endokrine Orbitopathie).
Zunächst steht die Behandlung der Hyperthyreose im Vordergrund. Grundsätzlich wird eine medikamentöse Behandlung mit Thyreostatika von einer ablativen Therapie durch eine Operation oder Radiojodtherapie unterschieden. In der Regel beginnt die Behandlung der Hyperthyreose mit einer thyreostatischen Medikation. Am häufigsten werden Thionamide eingesetzt. Carbimazol und Thiamazol hemmen die Schilddrüsenperoxidase und dadurch die Schilddrüsenhormonsynthese. Carbimazol ist eine Prodrug und wird erst in der Leber in das biologisch wirksame Thiamazol umgewandelt. Die Initialdosis von Carbimazol beträgt zwischen 15–60 mg pro Tag, Thiamazol wird mit 10–40 mg täglich niedriger dosiert. Propylthiouracil (PTT) stört zudem die Konversion (Dejodierung) von T4 zu T3. Aufgrund seiner kurzen Halbwertzeit muss es mehrmals täglich mit einer Initialdosis von dreimal 50–150 mg pro Tag eingenommen werden. Es ist weniger teratogen als Carbimazol und Thiamazol und wird daher im 1. Trimenon einer Schwangerschaft favorisiert. Alle Thyreostatika sind plazentagängig und beeinflussen dadurch die Schilddrüsenfunktion des Fetus. Thyreostatika haben keine Wirkung auf bereits im Körper befindliches Schilddrüsenhormon. Der therapeutische Effekt tritt erst mit dem körpereigenen Abbau der Hormone mit einer Latenz von frühestens sechs bis acht Tagen ein. Eine erste Laborkontrolle der Schilddrüsenfunktionsparameter (fT4, fT3, TSH) mit einer eventuellen Dosisanpassung der Thyreostatika sollte etwa zwei Wochen nach Therapiebeginn erfolgen. Die Intervalle der weiteren Laborkontrollen hängen vom therapeutischen Effekt und vom Verlauf ab. Nach Erreichen einer Euthyreose soll die Erhaltungsdosis sukzessive verringert werden. Es können verschiedene unerwünschte Nebenwirkungen auftreten. Neben allergischen Reaktionen an der Haut werden auch Leber und Blutbildveränderungen beobachtet. Daher sollten bei den Stoffwechselkontrollen auch routinemäßig die Leberwerte und das Blutbild überwacht werden. Die Gefahr eines akuten Leberversagens besteht bei einem signifikanten Anstieg der Leberwerte GOT und GPT (> Faktor 3 des oberen Referenzwertes) unter Propylthiouracil. Nahezu regelhaft führt bereits die unbehandelte Hyperthyreose zu einer Verschlechterung der Leberwerte, weshalb ein Ausgangsstatus vor der Verordnung von Thyreostatika ratsam ist. Wegen ihres nicht unerheblichen Nebenwirkungspotenzials sind Thyreostatika für eine Dauertherapie nur eingeschränkt geeignet. Bei schweren Nebenwirkungen kann zur kurzfristigen kompetitiven Hemmung der Jodaufnahme alternativ Perchlorat verwendet werden. Bei kardialen Reaktionen wie Tachykardien oder Herzrhythmusstörungen und insbesondere bei Patienten mit kardialen Risikofaktoren und Vorerkrankungen wird eine zusätzliche Behandlung mit Betablockern empfohlen. Die Verordnung des nichtkardioselektiven Betablockers Propranolol bessert nicht nur eine Sinustachykardie, sondern ist zugleich geeignet zur Behandlung eines feinschlägigen Fingertremors und zur psychovegetativen Stabilisierung. Zudem hemmt Propranolol die Konversion von T4 in T3.
Beim M. Basedow kommt es nach einer thyreostatischen Therapie in etwa 30–50 % der Fälle zu einer spontanen Remission (1,6). Daher ist in Deutschland ein sog. konservativer Behandlungsversuch mit Thionamiden über einen Zeitraum von 12 bis etwa 18 Monaten eine häufig favorisierte Therapie. Eine längere Behandlungsdauer führt mit großer Wahrscheinlichkeit nicht zu einer höheren Remissionsrate, bei einer kürzeren steigt die Rezidivrate. Bei großen Basedowstrumen (> 40 ml), primär oder persistierend hohen TRAK-Werten (> 10 U/l), bei jungen Patienten um 20 Jahre oder jünger oder auch bei Rauchern ist die Wahrscheinlichkeit auf eine langfristige Remission allerdings gering. Daher stellt sich bei solchen Konstellationen die Frage nach einer frühzeitigen, definitiven Therapie. Diese ist in der Regel auch bei Unverträglichkeit der thyreostatischen Therapie sowie bei therapierefraktärer und rezidivierender Hyperthyreose indiziert. Eine ablative Therapie erfolgt durch eine Operation oder eine Radiojodtherapie. Bei richtiger Durchführung ist sowohl die Radiojodtherapie als auch die Chirurgie sehr effektiv. Beide Verfahren haben grundsätzliche Vor- und Nachteile (Tab. 2).
| Operation | Radiojod |
|---|---|
| bei großer Struma (z. B. > 50 ml) | Kein OP-Risiko |
| bei Begleitpathologie (z. B. suspekter Knoten) | Kein Recurrenspareserisiko |
| bei florider endokriner Orbitopathie | Kein Hypoparathyreoidismusrisiko |
| rascher Wirkungseintritt | Keine Narbe |
| Geplante Schwangerschaft | bei Kontraindikation zur OP |
Nach einer unlängst publizierten skandinavischen Studie schätzen die Patienten ihre Lebensqualität im Spätverlauf nach einer Operation besser ein als nach einer Radiojodtherapie (7). Bei der Operation strebt man eine komplette oder fast-komplette Schilddrüsenentfernung an. Nach den bisherigen Zwischenergebnissen einer aktuellen wissenschaftlichen Studie ist es unerheblich, ob man zur Schonung der Nebenschilddrüsen und der Stimmbandnerven kleine marginale Schilddrüsenreste von < 0,5 Gramm belässt oder nicht. Die Ergebnisse und Komplikationsraten der chirurgischen Therapie werden wesentlich von der Erfahrung und Expertise des Chirurgen beeinflusst (8,9). Da beim M. Basedow durch die chronische Entzündung häufig erschwerte OP-Verhältnisse bestehen, sollte dies bei der Entscheidung für oder gegen eine Operation sowie bei der Auswahl einer geeigneten Klinik berücksichtigt werden. Nach einer erfolgreichen ablativen Therapie resultiert in der Regel eine iatrogene Hypothyreose. Therapie der Wahl ist Hormonersatz, mit L-Thyroxin behandelt. Führt diese Behandlung auch unter Ausnutzung verschiedener Tricks wie z. B. die Verteilung auf mehrere Einzeldosen oder Einnahmezeitpunkte nicht zur Beschwerdefreiheit und Zufriedenheit des Patienten, kann ein Therapieversuch mit T4/T3-Kombinationspräparaten hilfreich sein.
Bei einer akuten entzündlichen endokrinen Orbitopathie erfolgt in der Regel zunächst eine systemische Kortisonbehandlung. Je nach weiterem Verlauf bestehen weitere Therapieoptionen in einer Orbitabestrahlung, einer operativen Orbitadekompression sowie in verschiedenen augenärztlichen Korrektureingriffen. Da sich eine endokrine Orbitopathie unter einer Radiojodtherapie verschlechtern kann, wird die Radiojodtherapie in diesen Fällen mit einer Kortisonbehandlung verbunden. Viele Experten empfehlen beim M. Basedow mit einer endokrinen Orbitopathie alternativ lieber eine zeitnahe chirurgische Sanierung.
Mit Hilfe der Arzt- und Kliniksuche finden Sie Ihren Facharzt.